乳腺癌的治疗,不仅仅是对疾病的治疗,同时还需特别注重考虑患者的个体因素。比如是否要保留乳房的问题,患者的生活经历、价值观都不同,不同年龄段对生活的期望要求也不同,她们的精神压力也有差异。
乳腺癌的治疗手段很多,手术、新的抗癌剂、分子靶向药物、免疫细胞治疗、激素治疗等可以单独运用,也可以联合运用。根据肿瘤的进展程度和个体特性,医师建议最佳治疗选择,但是治疗方法应由患者本人决定。
和胃癌一样,日本的乳腺癌治疗水平与5年生存率在世界上位居前列。本期日本专家谈肿瘤,就来谈谈乳腺癌,由日本癌研有明病院乳腺中心的大野真司教授介绍日本对于乳腺癌的治疗是如何进行的。通过本文描述的乳腺癌治疗的方方面面,希望患者和家属阅读后能有所收获。
乳腺癌是什么疾病?
乳腺癌亦称乳癌,癌变发生在乳腺上,乳腺以乳头为原点呈放射网状分布在乳房内。乳腺癌的首次发现大多是体检时或发现乳房肿块等主观症状(也称“自觉症状”)时就诊后确诊的。
● 乳腺癌是发生在乳腺上的恶性肿瘤
乳腺在乳房内呈放射状,单侧乳房内有15~20个乳腺。在乳腺上发生的恶性肿瘤即为乳腺癌。乳腺是分泌乳汁的组织,主要包括制造乳液的小叶和运送乳汁的乳管(图1)。
小叶和乳管细胞异常病变增殖后乳腺癌就发生了。癌细胞局限于小叶或乳管上皮细胞内的为“非浸润性癌”,癌细胞扩散到小叶或乳管外的为“浸润性癌”(图2)。非浸润性癌不威胁生命,浸润性癌的微小癌细胞可能扩散到身体其他部位,需进行全身治疗。
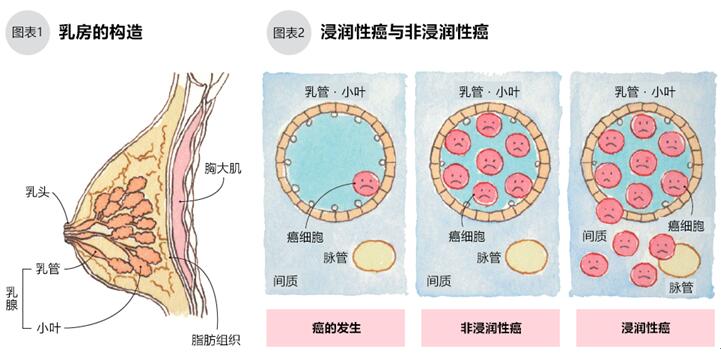
乳腺癌的组织分型中,90%的癌变发生在乳管上(乳管癌),5%的癌变发生在小叶上(小叶癌),还有5%为髓样癌、粘液癌等特殊类型。虽然组织类型不同,乳腺癌的发展性质和治疗方法却没有大的差异。
● 年轻患者占乳腺癌患者总人数的6%~7%
乳腺癌具有年龄段发病特征:30多岁女性患病风险增加;50~65岁发病者最多;20~30岁女性约占乳腺癌总发病人数的6~7%;男性占0.5%,男性乳腺癌发展速度比较快。
在调查数据中,乳腺癌的发现主要有两个途径,一是定期健康体检,进行钼靶和超声波检查后发现的;二是当发现乳房肿块、酒窝症等自觉症状后就医确诊的。2011年日本乳腺癌学会的调查显示,通过钼靶检查发现的乳腺癌占总患者数的28.4%,有主观症状后医学检查发现的占61.6%,通过体检发现的乳腺癌患者人数每年都在增加。
什么检查可以确诊乳腺癌?
经过视诊、触诊、钼靶、超声波等影像检查,最后通过显微镜下观察癌变组织的病理诊断才能确诊乳腺癌。当怀疑乳腺癌时,请先通过问诊、视诊、触诊、钼靶、超声波检查确认是否存在病变或肿块。医师诊断时要先观察乳房,查看乳头是否有分泌物,乳房皮肤上是否有湿疹,触摸确认肿块的位置,大小和硬度,颈下和腋下淋巴结有无肿大等(图3)。

钼靶是用于乳房检查的X光专用透视设备,可以确认视诊和触诊无法明确的微小病变和钙化。钙化是指乳房内沉积钙的现象,大多数的钙化是良性的,但整个乳房只有1个钙化点时需要注意,有癌变的可能。超声波能清楚的观察乳房内肿块,绝经前的女性乳腺密度增高,此时钼靶不易辨别病变,但是超声波检查不受乳腺密度变化影响。
●病理检查诊断良性、恶性
经过上述检查,高度怀疑乳腺癌的,或者难以辨别良性、恶性的,须行穿刺抽吸细胞学诊断或者穿刺组织活检病理诊断。如果已被确诊为乳腺癌,还需要辨别癌的性质。
进行穿刺抽吸细胞学诊断时,用细针头刺入病变位置后将细胞吸入针管中,然后将抽吸的细胞染色,在显微镜下观察。穿刺活检时,需要局部麻醉,用较粗的针刺入病变处采集病变组织,染色后在显微镜下观察,做病理诊断。穿刺活检的诊断结果比抽吸细胞诊断更准确,绝大多数医疗机构采用穿刺活检的方法。
穿刺活检用的器械有2种,芯针活检和抽吸活检。芯针活检单次可采集的组织有限,采集到的标本数量不够做明确的病理诊断时,需进行抽吸采样,抽吸活检凭吸力可以采集更多的病变组织,有助于病理诊断。抽吸活检采集到的组织仍然不能明确诊断的,就需要手术切开乳房,进行术中或术后病理诊断了。
病理诊断确诊乳腺癌的,需配合CT、MRI等检查以确认肿瘤的全身扩散范围。
分期和治疗方法
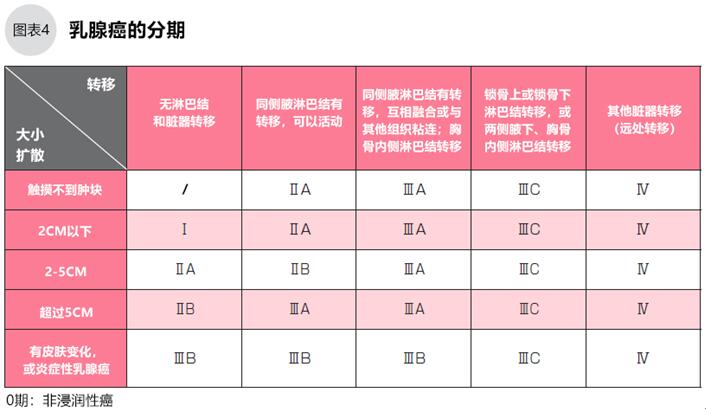
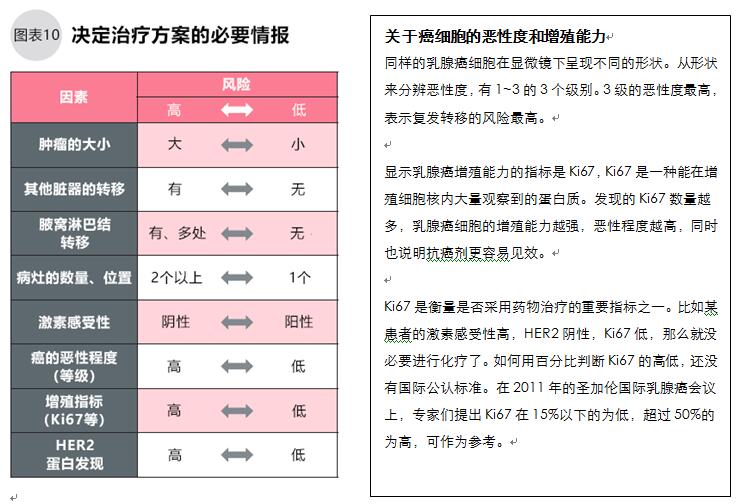
乳腺癌的分期按肿瘤大小、有无淋巴结转移、脏器转移分为0~Ⅳ期。选择治疗方法时考虑肿瘤大小、扩散情况、病理诊断的肿瘤性质等。
分期(Stage)是了解患者病情、预后和选择治疗方法的重要指标。根据肿瘤大小、周围淋巴结和脏器转移情况,将乳腺癌分为0、Ⅰ、ⅡA、ⅡB、ⅢA、ⅢB、ⅢC、Ⅳ期的8个阶段。0期是非浸润性癌,Ⅰ期以后是浸润性癌,越靠近Ⅳ期就越接近晚期(图4)。
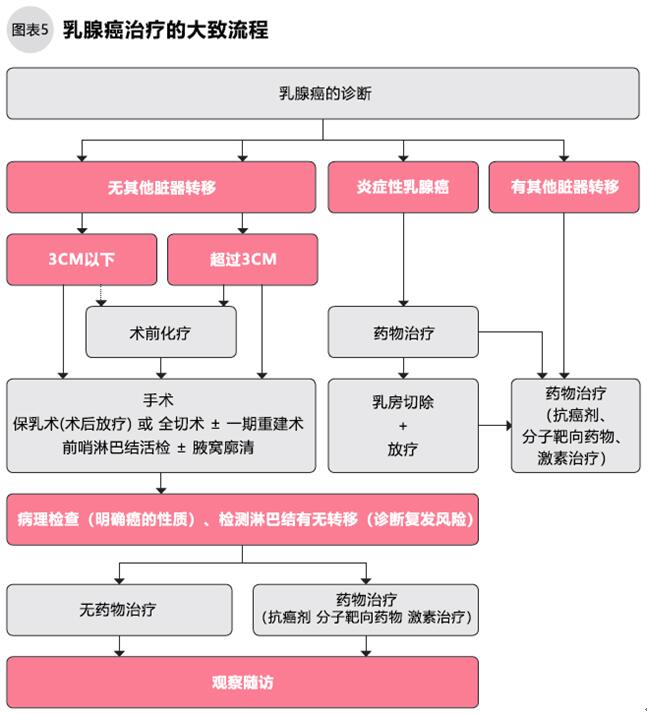
乳腺癌的治疗包括手术、放疗等局部治疗以及化疗、激素治疗、免疫细胞治疗等全身治疗,多数中晚期患者需要全身治疗(图5)。日本乳腺癌学会制定了治疗指南,指南是根据临床经验和专家们探讨后制定的,具有权威性。指南中规定了手术、放疗、药物治疗的标准,这些治疗亦称“标准治疗”。
● 综合考虑肿瘤的性质、身体状况、患者意愿后选择治疗方针
选择什么样的治疗方法,要综合考虑病理诊断的肿瘤性质、分期、患者的身体状态(是否闭经、脏器功能是否良好)以及患者本人的意愿。比如患者是炎症性乳腺癌,乳房红肿并伴有脏器转移,那么最初应该选择全身性的药物治疗,而不是手术。后文详述根据乳腺癌的性质指标选择用药。患者在选择治疗方法前应在医师处先询问清楚病理诊断结果、影像诊断结果、分期和肿瘤的性质。有多种治疗选择时,先明确治疗的目的、治疗内容、风险、获益、治疗所需时间和费用等,根据医师的建议选择患者认同的治疗方法。
乳腺癌的手术方法和乳房重建术
治疗乳腺癌的标准手术方法有保乳手术和全乳房切除术两种。希望接受乳房再建术的患者,在切除手术前就得做准备。
● 保乳手术和全乳房切除术
乳腺癌的手术目的有2个:①局部切除肿瘤;②对手术切除的病变组织进行病理诊断,明确肿瘤性质。
保乳手术又称乳房温存手术,只切除乳房内的病变及周围部分,无需切除整个乳房;全乳房切除术指保留胸大肌和胸小肌等,摘除整个乳房。临床数据显示保乳术联合放疗与全乳房切除术的生存期等治疗效果是相同的。
保乳术的适应症条件取决于肿瘤和乳房的大小平衡。一般情况下3cm以下的肿瘤可行保乳术;患者希望保留乳房的,需要在手术前接受新辅助化疗。保乳手术也不能保证术后乳房不变形。在日本,医师与患者沟通治疗方案时,除了对治疗过程、手术风险和预后进行说明外,还在现场用手绘图或图片向患者说明术后乳房的形状、伤痕。
患者不希望接受保乳术治疗的,出现以下三种情况时才行全乳房切除术。
①同一个乳房内有2个以上肿瘤病灶,并距离较远;
②大范围转移的乳腺癌;
③病灶的位置无法放疗,或者妊娠中不能接受放疗。
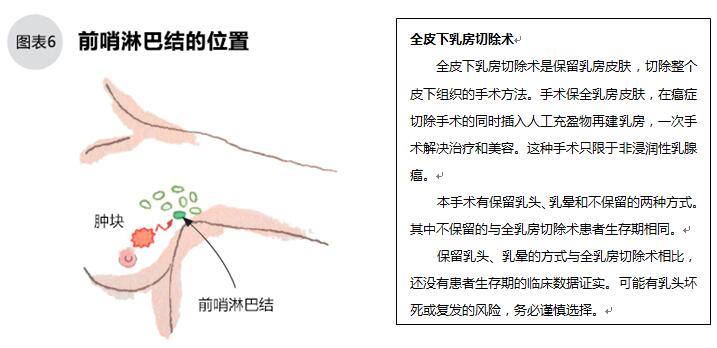
●什么是前哨淋巴结活检
治疗标准规定,无论患者接受何种方式的手术,术前已经明确腋下淋巴结转移的,须行淋巴结廓清术。廓清(切除)腋下淋巴结的目的是诊断转移的淋巴结个数、大小,以预判复发风险,采取防复发治疗。
即使在术前触诊和影像诊断无淋巴结转移的,也必须在术前或术中进行前哨淋巴结活检,在显微镜下判断是否有淋巴结转移(图6)。腋下的多组淋巴结中,前哨淋巴结是乳腺癌最先侵袭的一组,如果无前哨淋巴结转移,可评估其淋巴结转移的风险很小,不用行腋下淋巴结廓清术。近年来的研究表明,前哨淋巴结发生2mm以下微小转移的,是否行腋下淋巴结廓清术对患者预后无影响,因此治疗指南明确:微小转移不需要行腋下淋巴结廓清术。
●乳房再建术
乳房再建术指,用整形外科的技术将手术后丧失或变形的乳房重建的方法。希望接受乳房再建的患者须在手术前与医师探讨方案。乳房再建可以在乳腺癌手术中或手术后进行,乳腺癌术中再建的,可能影响到手术方法的选择,需要乳腺外科和整形外科,以及患者参与讨论方案。
全乳房切除术或者全皮下乳房切除术+乳房再建术的美观效果比保乳手术的好。乳房再建术与乳腺癌的复发无关,也不延迟复发后的检出时间。乳腺癌手术时进行再建的称为一次再建,乳腺癌手术后进行再建的称为二次再建。一次再建对患者失去乳房的精神打击小,住院一次就能完成治疗。乳腺癌术后需要随访观察的,过一段时间可进行二次再建。
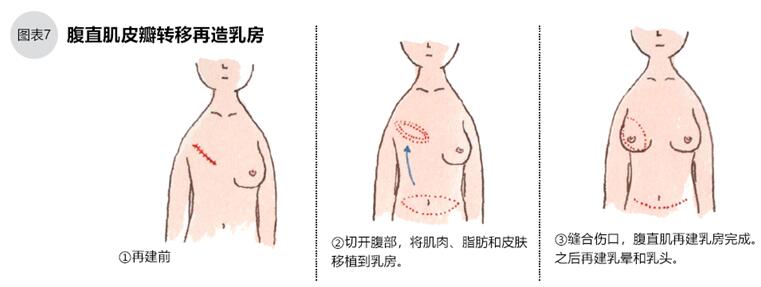
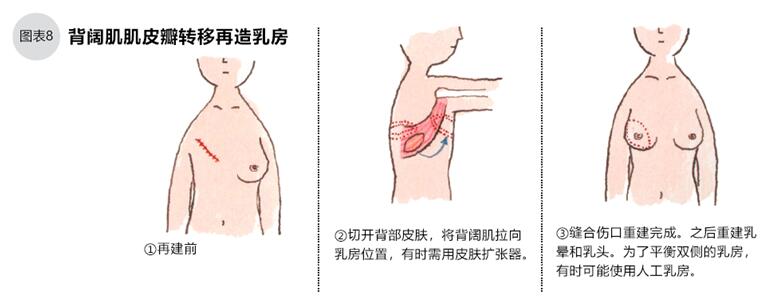
乳房再建术的填充材料,可使用自体组织,也可使用人工乳房。用自体组织的有三种移植方法:“皮瓣再建术”移植腹部肌肉、脂肪和皮肤(图7);“穿通支皮瓣再建术”移植腹部、臀部富含血管的脂肪、皮肤组织;“背肌皮瓣再建术”移植背部肌肉等。其中传统支皮瓣再建术不移植肌肉组织,患者伤痛较小,但是这个手术非常难,只有极个别医院可以完成。
再建人工乳房时,先将气球状的皮肤扩张器插入胸肌下(图10),再用生理盐水舒展皮肤,最后插入人工乳房。任何形式的乳房再建术都须先再建乳房,等乳房稳定后再建乳晕和乳头。有必要时可安装触摸式乳房和乳头。

选择自体组织填充乳房的,具有和身体接近的柔软度,更真实,但是腹部等移植部位会留下疤痕。选择人工乳房虽然不用在身体上再添新伤,但是随着年龄变化另一侧乳房将下垂,不平衡状态会影响美观。人工乳房的选择,需深思熟虑。
图表10 乳房再建术的人工材料

乳腺癌的放射线治疗
保乳手术后或者全乳房切除术腋下淋巴结有转移的,以及肿瘤直径较大的,需行放射线治疗预防乳腺癌复发。放疗也可以用于缓解局部疼痛。
放射线作用于细胞增殖相关的遗传基因,有杀死癌细胞,阻止癌细胞增殖的作用,属于局部治疗。术后放疗的目的是预防癌细胞在未切除的乳房、胸壁以及附近淋巴结死灰复燃。保乳术后必须进行放疗,保乳手术时为了尽可能完全切除病灶和可能扩散的癌细胞,需要扩大切除范围,切除肿瘤及周围组织。手术后不可视的微小癌细胞仍有可能在存留乳房内,这时用放射线照射可降低复发的风险。保乳术后行放疗相比不放疗的,乳房内复发的风险可降低1/3。术后乳房内再复发的,需切除整个乳房。
放疗已经是保乳手术治疗标准的一部分,术后放疗每次接受1.8~2.0Gy(线量单位)的照射,照射25次,合计45~50Gy,整个放疗约5周完成。对腋下淋巴结转移较多的患者,还需放射线照射锁骨上淋巴结。术后辅助放疗每次的照射时间仅1~2分钟,无需住院,对患者的正常生活几乎无影响。因为放射线也伤害正常细胞,所以单次照射线量不能过高。
接受全乳房切除术的患者,如果腋下淋巴结转移超过4个,或者肿瘤直径大于5cm的,为了降低复发风险,除了行药物治疗外也需接受放射线治疗。照射肿瘤侧胸壁和锁骨上窝,每次照射线量1.8~2.0Gy,共照射25次。
放射线不可视,也没有灼热和疼痛的感觉,但是治疗过程中或者治疗后数月内可能出现乏力、皮炎、放射性肺炎等副作用。
需要放化疗联合治疗的,药物治疗结束不可立刻放疗,等副作用缓解后(约1个月)才开始放射线治疗。发生骨转移的,放疗可以缓解疼痛症状。
药物治疗的种类和选择方法
乳腺癌的药物治疗包括抗癌剂、激素药物、分子靶向药物。治疗方法的选择须综合考虑肿瘤分期、癌细胞性质、年龄、意愿等因素。
乳腺癌大多为全身性疾病,发现时即使肿瘤很小,但是很可能在身体中潜伏着不可见的微小癌细胞,有微小转移的风险(如图10),药物治疗是对抗微小转移的重要治疗手段之一。
根据治疗的目的和阶段,乳腺癌药物治疗包括:①为使肿瘤缩小,保乳术前进行的药物治疗;②手术后为预防复发进行的药物治疗;③发现乳腺癌时已经远处转移或者复发后进行的药物治疗。乳腺癌的药物治疗包括抗癌剂、激素药物、分子靶向药物3类。治疗用药及其组合的选择,须综合考虑癌细胞的性质(激素感受性高低、有无HER2蛋白质)、复发风险和患者意愿。
选择激素和靶向药物治疗的,需明确肿瘤具备对药物反应的敏感性,否则治疗无效。强烈建议患者了解自己的肿瘤性质、复发风险和治疗方法后再选择治疗方式。
● 术前缩小肿瘤的“术前化疗”
肿瘤超过3cm且患者不愿接受全乳房切除手术的,可尝试在术前接受新辅助化疗,待肿瘤缩小后再行保乳手术。另外,炎症性乳腺癌须在手术前接受药物治疗,肿瘤缩小,炎症缓解后才可接受手术。
术前化疗的时间一般需要3~6个月。HER2阳性的药物组合为抗癌剂+分子靶向药物-曲妥珠单抗。对于可手术乳腺癌的治疗,术前术后化疗几乎不影响患者的生存期和复发率。术前化疗可使70~90%的患者肿瘤缩小。
经术前化疗肿瘤缩小的可行保乳手术,手术切除范围也随之缩小。术前化疗使肿瘤完全消失的,比不能完全消失的患者复发率降低约50%,肿瘤和腋窝淋巴结转移同时消失的,其复发率可降低70~80%。使用抗癌剂和分子靶向药物化疗有其相应的评估指标。现在有很多临床试验,其结果有可能改变乳腺癌术后治疗的选择。
患者绝经、激素感受性高、可手术的,可在术前进行3~6个月的激素药物治疗。目前临床上还未证明非绝经患者在术前接受激素治疗的效果,除了临床试验,不可对该类患者进行激素治疗。
术前化疗也有缺点,化疗后肿瘤消失或缩小的,很难通过术后镜下病理诊断判断癌细胞的性质。另外,也有术前化疗后肿瘤增大的。同时,如果患者希望立刻切除肿瘤时,不建议术前化疗。
“有激素感受性”是激素治疗的条件
激素感受性是指癌细胞接受女性雌激素和黄体激素刺激后,增殖的可能性。具有激素感受性的癌细胞与激素受体结合后可促进癌细胞增殖。是否具有激素感受性,可通过免疫组织化学检查判断。发现雌激素受体(由雌激素活动产生)和黄体激素受体的任何一种,都叫“有激素感受性”,或者称“激素受体阳性”。阳性可选择激素药物治疗。
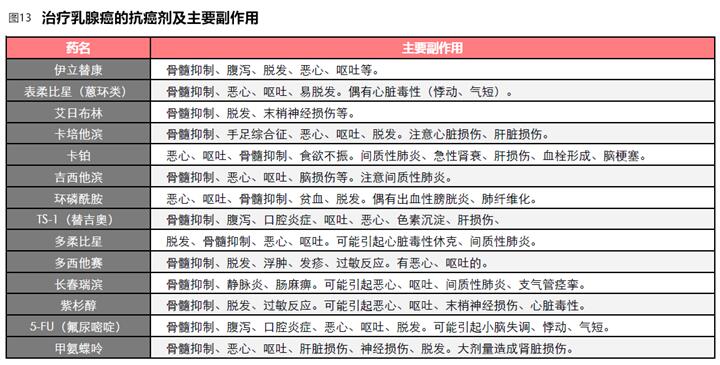
● 抗癌剂治疗(狭义的化疗)
具有手术适应症的乳腺癌患者适合化疗的,主要指HER2阳性、或者激素受体阴性+HER2阴性(常说的三阴乳腺癌)。具有激素感受性的患者应以激素药物治疗为主,但是当Ki67高值,腋窝淋巴结转移4个以上,肿瘤范围大,复发风险高时,需要进行抗癌剂治疗,其中HER2阳性的可用抗HER2抗体药物。
预防复发的抗癌剂治疗,目前效果最好的是AC方案(多柔比星+环磷酰胺3周1次共4次)等蒽环类药物治疗后,追加紫杉类药物(紫杉醇、多西他赛)治疗。术前术后用药方案相同。
发生远处转移的,注意调节减少副作用的同时,尽量做到将一个方案用的时间更长。
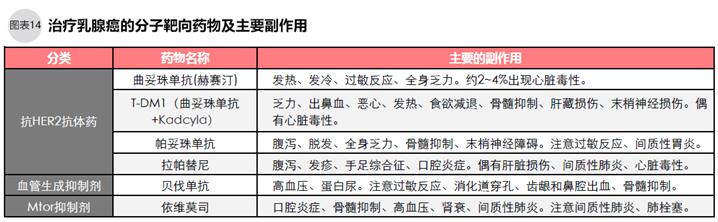
●副作用相对较少的分子靶向药物
癌细胞的生存、转移与众多分子(蛋白质、遗传基因等)有关。只针对某一特定分子进行攻击的药物称为分子靶向药物。化疗用的抗癌剂除了杀伤癌细胞还伤害正常细胞,靶向药物只攻击与细胞增殖相关的分子,相对化疗的脱发、呕吐等强副作用,靶向药物副作用小。
治疗乳腺癌的代表性靶向药物有:曲妥珠单抗、帕妥珠单抗、拉帕替尼、T-DM1(曲妥珠单抗和抗癌剂的偶联物 kadcyla)等抗HER2药物。HER2受体是癌细胞增殖的必需物质,这些靶向药物通过攻击HER2受体可起到抑制癌细胞增殖的作用。注意,这些药物只对HER2阳性的患者有效。乳腺癌中HER2阳性患者约15~20%。术前术后使用曲妥珠单抗后追加紫杉类抗癌剂(紫杉醇、多西他赛)1年的,可降低复发率36%。
过去,HER2阳性的乳腺癌患者预后不好,自从曲妥珠单抗登场后,生存率有了很大的改观。HER2阳性的患者复发后,仍可用抗HER2抗体药物+抗癌剂联合治疗,或者同时使用2种抗HER2抗体药物进行治疗。
●绝经前后的激素治疗
在乳腺癌中,有些是受到女性雌激素、黄体激素刺激后令癌细胞增殖的。对有激素感受性的患者实施激素治疗,减少体内雌激素,阻碍黄体激素受体正常运行,可有效抑制癌细胞增殖。女性荷尔蒙的分泌情况在绝经前后大有不同,因此绝经前后的激素治疗方法也不同。在无法判断是否已经绝经时,可从血液中测量雌激素和促卵泡激素。
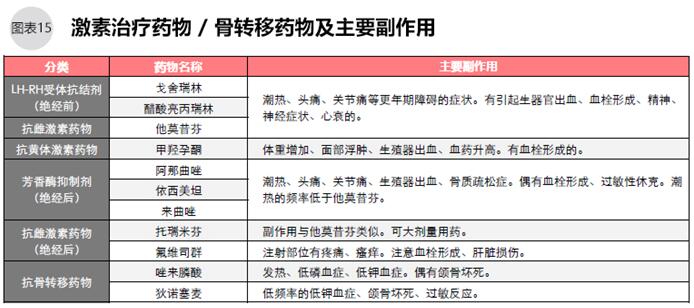
绝经前只有卵巢分泌雌激素,神经系统的下丘脑发出指令后,脑垂体分泌性刺激激素,卵巢接收到性刺激激素刺激后开始分泌性激素。乳腺癌激素治疗药物LH-RH受体抗结剂可阻断大脑神经向卵巢发送指令,从而抑制卵巢分泌雌激素。临床上,绝经前的乳腺癌患者术后需使用LH-RH受体抗结剂,每个月1次或每3个月1次皮下注射,持续治疗2~5年;使用口服药物他莫昔芬的,持续治疗5~10年。
绝经后卵巢不再分泌雌激素,在脂肪组织内的芳香酶作用下,肾上腺分泌的雄激素可转化为雌激素。芳香酶抑制剂有阻止雌激素生成的作用,抑制癌细胞增殖。标准治疗方案中,有激素刺激性的绝经后乳腺癌患者,为了预防复发,术前术后总计服用5年芳香酶抑制剂。
服用他莫昔芬2~5年后绝经的,再服用芳香酶抑制剂2~5年,其预防效果更好。有激素感受性的患者,即使发生了复发转移,仍需持续使用激素抑制剂、依维莫司等mTor抑制剂。
●精准治疗
一般情况下,对有激素感受性、腋窝淋巴结转移、Ki67高的患者进行抗癌剂治疗(HER2阳性的联合抗HER2抗体药物)后,再行激素治疗。但是,对具有中度复发风险的患者(2级、无淋巴结转移、Ki67中等)是否需要化疗,专家们的意见还不统一。
这时需要进行基因检测,Oncotype DX检查用于预测乳腺癌复发风险和抗癌剂的有效率,事先评估抗癌剂的效果可避开无效的化疗。费用约40~50万日元。
容易罹患乳腺癌、卵巢癌的基因有哪些?
很多种类的癌症与吸烟、偏食、环境以及生活习惯不良有关,据说遗传基因因素占罹患乳腺癌的5~10%。至今为止的研究显示,很多患者罹患乳腺癌的原因是身体中负责细胞癌变后进行修复的基因发生突变引起的,这些基因主要是BRCA1、BRCA2。BRCA1和BRCA2中任何一个发生突变后,年轻人更容易罹患乳腺癌,其具有双侧乳房同时发症,单侧乳房发生不同种类乳腺癌的特点。
很多国家都有专业的医疗机构进行基因检测和咨询,可明确BRCA1和BRCA2是否存在突变,日本的费用约20万日元。如果患者了解自己是遗传性乳腺癌,请务必告诉自己的女性亲属,建议她们接受基因检测和咨询。遗传性乳腺癌的治疗,需更慎重的考虑治疗方针,如放弃保乳术行全切术,定期检查对侧乳房和卵巢等。
手术的后遗症
乳腺癌手术的主要后遗症是淋巴浮肿和慢性疼痛。有的肩关节活动困难,请坚持康复操,寻求专业医师指导。
●康复操有助于预防淋巴浮肿
腋下淋巴廓清术可能使淋巴液从淋巴管中泄露,造成肩关节活动障碍。为了预防淋巴浮肿,术后在淋巴液引流期间可做用手握橡皮球的练习;经常活动每根手指;拔掉引流管后练习上举手臂;活动肩关节等康复运动,1天3次,坚持3个月(如图11)。
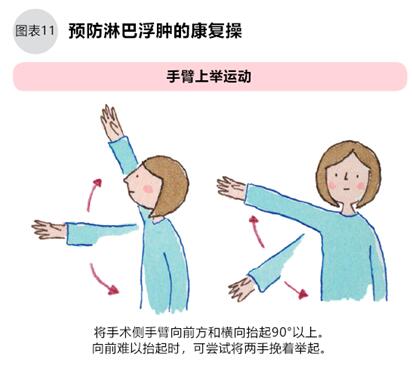
手术的后遗症主要由淋巴廓清术或放疗引起,淋巴液在淋巴组织外积存后可造成手臂浮肿。康复练习有助于预防淋巴浮肿,另外患者需注意避免拿重物,避免剧烈运动,避免着拘束服装。皮肤受损后可增强手臂的血液循环,更容易引起淋巴浮肿,康复期请注意外伤、虫咬、日晒、细菌感染等。千万不可针灸,会起反作用。
浮肿超过1cm的须及时就医接受治疗。淋巴浮肿主要治疗方法是压迫治疗,着高弹力服装、弹力绷带运动,推拿淋巴引流,皮肤保湿。
●不要自己忍受术后疼痛
临床上对术后患者用镇痛剂、止痛药缓解疼痛,有时效果不佳,请务必联系医护人员。疼痛是越忍越痛的,过晚干预治疗的,就不得不提高镇痛剂级别了(止痛有三个级别)。另外,淋巴廓清术后可能影响腋下感知。一般术后数月内患者都可能有疼痛、不适、麻木、无知觉的症状。忍耐疼痛,一部分人可能缓解,另一部分人会感觉越来越疼,疼痛影响睡眠和正常起居时,请积极就医接受疼痛治疗。
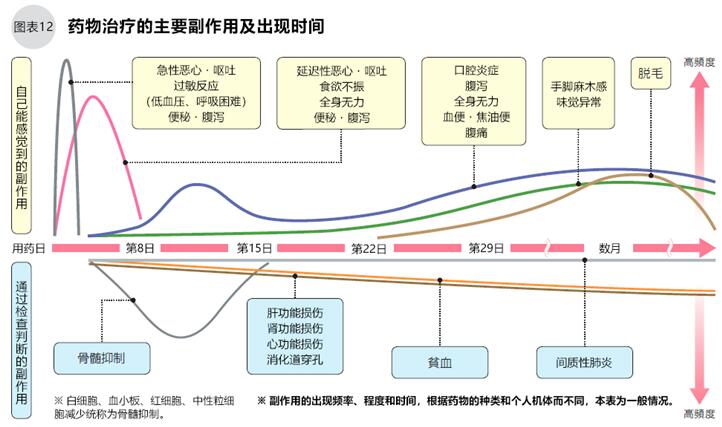
药物治疗的副作用和出现时间
关于化疗的副作用,开始化疗后,恶心、过敏反应和血管疼痛多出现在24小时内;骨髓抑制、乏力、腹泻、口腔炎症一般在第3天到二周后出现;脱发、血栓形成一般在2周至1个月以后出现。
药物治疗的副作用及其症状因药物种类和个体差异而不同。针对恶心、呕吐,现在已经开发出了很多药物,可有效控制副作用。请在化疗前掌握副作用的相关信息,有助于患者冷静的接受治疗(图12~16)。
副作用分为可自行处理的与需就医处理的,有自觉症状和初期无症状但在医疗机构检查后诊断出的。多数用于乳腺癌治疗的抗癌剂副作用是骨髓抑制(血小板、白细胞、红细胞、中性粒细胞减少)。表柔比星、环磷酰胺、多柔比星等易引起强烈的恶心、呕吐,在这些药物点滴的同时加入止吐药物,口服血清素抗体抗结剂和类固醇药物可缓解症状。
表柔比星、多柔比星、多西他赛、紫杉醇等容易引起脱发(脱毛),脱发一般于用药后2周开始,有时睫毛和眉毛等也会脱落。注意蒽环类药物(表柔比星、多西他赛)的副作用。紫杉类药物损伤神经,多引起手脚知觉麻痹等,严重时不能按电梯按钮、手拿不住东西。对日常生活造成影响时请就医处理。
分子靶向药物的副作用没有抗癌剂引起的骨髓抑制、脱发等那么严重,抗HER2抗体药物曲妥珠单抗、帕妥珠单抗、TMD-1等偶尔发生心脏毒性(心功能损伤、心衰),出现这些副作用时应停止用药。贝伐单抗可能引起高血压、蛋白尿、鼻齿出血、骨髓抑制。
抗激素药物的副作用比抗癌剂小,副作用包括红潮、热潮、更年期障碍、性器官出血、精神神经症状等,偶有引起血栓形成,肺栓塞、脑梗、心梗的。LH-RH抗结剂、芳香酶抑制剂容易引起关节疼痛、骨质酥松。
通常多药联合治疗比单药治疗更容易出现副作用,副作用严重时须减少药量、换药甚至停药。
在接受药物治疗前,请了解药物的副作用和应对副作用的方法。

出现这些症状是须立刻就医
发热38度以上伴随疼痛或出血
强烈胸痛、悸动、气短、持续控咳
持续呕吐、腹泻、无法饮水
手脚感觉麻木严重、疼痛
复发转移后的治疗方法
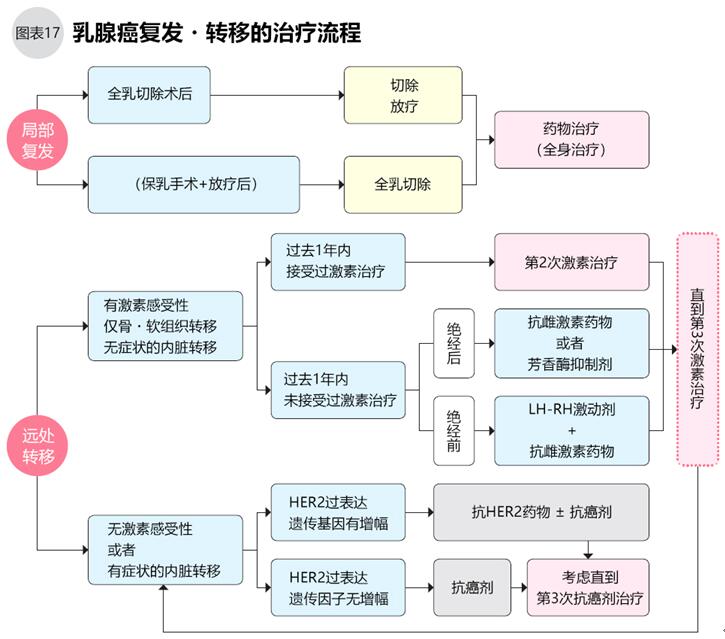
乳腺癌的复发包括“局部复发”和“远处转移”两大类。局部复发的可用手术切除、放疗和药物治疗,远处转移的可用药物和免疫治疗,与癌共存。
乳腺癌的复发和其他实体肿瘤相似,肿瘤形成初期的微小癌细胞流入身体,在初次治疗时没能彻底杀灭它们,之后癌细胞增殖成肿瘤。在手术过的乳房、及周围的皮肤、淋巴结再长出肿瘤的为“局部复发”,在肝脏、肺、骨长出肿瘤的为“远处转移”。乳腺癌患者中,也有经过10年以上再复发转移的。
●局部复发再手术
保乳治疗后乳房内复发的,一般须行全乳房切除术。再行保乳手术的只限于第一次治疗不干净的极小肿瘤。
全乳房切除术后2年以上周围皮肤或胸壁复发的,无远处转移,可手术切除肿瘤及周围组织。没接受过放疗的,术后须辅助放疗。
从手术到复发时间不超过2年而局部复发,如炎症性乳腺癌,皮肤、胸壁发红的,先行抗癌剂、靶向药物化疗、激素治疗,同时可接受几乎无副作用的免疫细胞治疗,起效后行手术或放射线治疗。
●远处转移以全身治疗为主
乳腺癌发生肺、肝脏、骨等远处转移的,因癌细胞已经扩散到全身,手术很难治疗。药物治疗可能抑制癌细胞增殖,免疫治疗可能提高自身抗肿瘤能力,缓解症状,尽量控制肿瘤发展与癌共存,偶尔有治愈的。
药物治疗的选择需考虑患者的激素感受性,有无HER2蛋白等癌细胞的性质,患者的身体状态(是否绝经、脏器功能)及个人意愿。上文介绍了乳腺癌的常用药物,包括蒽环类药物、紫杉烷类药物、植物中提取的长春碱类药物、以及抗代谢药物吉西他滨、卡培他滨等,一种药物无效时更换其他药物再尝试。
对HER2阳性的患者可用紫杉烷类药物+分子靶向药物联合治疗。曲妥珠单抗、帕妥珠单抗、T-DM1、拉帕替尼等抗HER2药物可单独使用或与他药联合使用。
有激素感受性的人复发转移后,原则上使用抗雌激素药物、LH-RH抗结剂、芳香酶抑制剂等单药或联合治疗。有激素感受性并HER2阳性的,除了激素治疗,也可以用抗HER2药物和激素治疗配合,或者激素治疗+抗HER2药+抗癌剂治疗(图17)。
骨转移的,除了针对乳腺癌的药物治疗外,可使用唑来膦酸或狄诺塞麦抗骨转移,必要时接受骨放疗或骨外科治疗。脑转移的以放疗为主,只有1处病灶且无其他脏器转移的可考虑手术。
免疫细胞治疗是免疫治疗的一种,如欲了解详细情况,请联系《日本就医网》-微信服务号同名。
随着治疗手段和技术的发展以及药物治疗的进步,乳腺癌患者发生复发转移的也可能得到很好的控制,在与癌共存的情况下能长期正常工作、生活的患者越来越多。